Piles et production d’énergie
Réaction spontanée : toute réaction chimique qui peut se dérouler sans apport d’énergie du milieu extérieur est appelée réaction spontanée.
Une pile électrochimique est un générateur qui transforme de l’énergie chimique en énergie électrique.
Une pile est constituée par deux demi-piles reliées par un pont salin. Une demi-pile est l’ensemble constitué d’un métal plongeant dans une solution contenant son cation conjugué. Les deux métaux sont appelés électrodes et constituent les pôles de la pile.
- L’électrode qui est le siège de l’oxydation est appelée anode et constitue le pôle - de la pile.
- L’électrode qui est le siège de la réduction est appelé cathode et constitue le pôle + de la pile.
Rôles du pont salin : fermer le circuit, apporter les porteurs de charges, assurer l’électroneutralité des solutions.
Représentation formelle d’une pile : ici pour la pile Daniell :
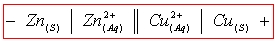
Lorsque la pile est à l’équilibre, il ne se produit plus de réaction aux électrodes, il n’y a donc plus de transfert indirect d’électrons à l’extérieur du générateur. L’intensité du courant est alors nulle.
Quantité d’électricité fournie :
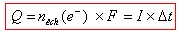
avec
Q la quantité d’électricité en Coulomb (C)
n la quantité de matière d’électrons échangés an moles (mol)
F le faraday : 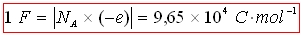
I l’intensité du courant en ampère (A)
Δt : le temps de transfert des électrons en seconde (s)