Etat d’équilibre d’un système
Quotient de réaction associé à la réaction suivante :
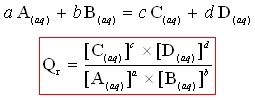
On ne fait figurer dans l’expression de Qr que les concentrations des espèces dissoutes.
A une température donnée, le quotient de réaction à l’équilibre Qr,éq est une constante quelque soit l’état initial considéré :
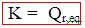
La constante d’équilibre dépend uniquement de la température.
La constante d’équilibre de la réaction d’un acide sur l’eau se note KA (constante d’acidité)
Le taux d’avancement final d’une réaction à température donnée dépend de la constante d’équilibre (plus cette constante est grande, plus le taux d’avancement est grand), mais dépend aussi dépend des conditions initiales.
Prévision de l’évolution du système
Lorsque le système est dans un état tel que Qr,i < K, l’évolution spontanée se produit dans le sens de la consommation des réactifs (sens direct)
Lorsque le système est dans un état tel que Qr,i > K, l’évolution spontanée se produit dans le sens de la consommation des produits (sens indirect)
Loi de Le Châtelier :
Lorsque l’on modifie la quantité de matière de l’une des espèces chimiques présente dans un système chimique à l’équilibre, l’évolution s’oppose à cette modification :
- si une espèce chimique est apportée, l’évolution se fait dans le sens de sa consommation.
- si une espèce chimique est éliminée, l’évolution se fait dans le sens de sa production.