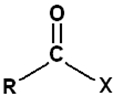
Nomenclature de chimie organique
Les hydrocarbures :
les alcanes : formule : CnH2n+2 ; terminaison en « ane »
les alcènes : double liaison carbone ; formule : CnH2n ; terminaison en « ène »
les alcynes : triple liaison carbone ; terminaison en « yne »
Les molécules avec groupe caractéristique oxygénés :
les alcools : terminaison en « ol »
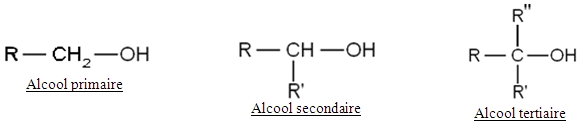
(ex : propan-2-ol : la fonction alcool est portée par le carbone n°2)
les aldéhydes : terminaison en « al »
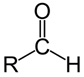
(ex : éthanal : le groupe caractéristique étant en bout de chaîne, il ne peut pas y avoir d’indice devant la terminaison –al)
les cétones : terminaison en « one »
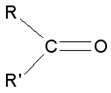
(ex : butan-2-one : le groupe est porté par le carbone n°2)
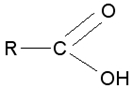
les acides carboxyliques : terminaison en « oïque »
Les composés halogénés :
Ce sont les molécules qui possèdent un ou plusieurs atomes de chlore, de brome, d’iode ou de fluor.
Leur nom commence par le préfixe « chloro », « bromo », « iodo » ou « fluoro » accolé au nom de l’alcane ayant le même nombre d’atome de carbone.
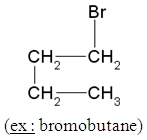
Les esters :
On commence par nommer la partie de la molécule issue de l’acide carboxylique (R ici) en lui ajoutant la terminaison -oate ; puis on nomme la partie issue de l’alcool en lui ajoutant la termaison –yle.
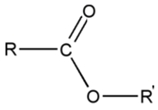
(ex : le propanoate de méthyle est issu de l’acide propanoïque et du méthanol)
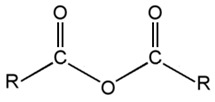
Les anhydrides d’acide :
Leur nom commence par « anhydride », la deuxième partie est le nom de l’acide dont est issu l’anhydride.
(ex : anhydride éthanoïque)
Les halogénures d’acyles :
Son nom commence par le nom de l’ion halogène X- suivi de « de » et du groupement R avec pour terminaison « yle ».
(ex : chlorure de propyle)